Il SARS-CoV-2 è un virus che purtroppo non necessità particolari introduzioni. Causa della malattia denominata COVID-19, questo virus negli ultimi anni ha segnato in maniera indelebile le nostre vite causando una pandemia non ancora conclusa. Nonostante il SARS-CoV-2 sia ancora diffuso, la nostra quotidianità è però tornata ai ritmi e alle libertà pre-COVID-19 grazie alla più grande campagna vaccinale della storia dell’umanità. La ricerca ha risposto in tempi rapidissimi durante la pandemia portando alla generazione di svariati vaccini, unico strumento valido per debellare una malattia.
La ricerca non si è focalizzata solamente sulla prevenzione, ma anche sulla caratterizzazione del patogeno al fine di espandere la nostra conoscenza su questo virus e di sviluppare cure più efficaci. Tra i laboratori che hanno reindirizzato i propri progetti sul SARS-CoV-2 troviamo il Virus and Immunity lab del prestigioso Pasteur Institute di Parigi. Il Professor Olivier Schwartz, che da anni si occupa di virologia con particolare attenzione ai virus dell’HIV, Zika e Dengue, nel 2020 ha deciso di focalizzarsi sul SARS-CoV-2 per contribuire alla lotta contro la pandemia. Oltre agli studi di virologia “classica” (studio della replicazione virale, l’ingresso nella cellula ospite, infettività, ecc.), Schwartz si occupa anche della risposta immunitaria dell’ospite e di come specifici anticorpi possono rallentare o bloccare le attività di un determinato virus.
Tra i processi d’interesse del Prof. Schwartz troviamo la virus-driven cell-cell fusion, ovvero la formazione di cellule multinucleate causata dall’infezione virale. La fusione tra cellule è un processo che avviene nel nostro corpo in condizioni fisiologiche per determinati processi, come la rigenerazione muscolare, la risposta immunitaria o la fecondazione. La cell-cell fusion indotta da un’infezione virale però è da considerarsi patologica. I virus possiedono principalmente due modalità di trasmissione tra cellula a cellula. Generalmente, la diffusione di un virus avviene tramite rilascio di particelle virali dalla cellula infettata che diffondono fino a trovare una nuova cellula target. D’altro canto, molti virus possono propagarsi in altre cellule senza diffondere nello spazio extra-cellulare, inducendo appunto la fusione della cellula infettata con altre sane.
Per affrontare lo studio di questo nuovo virus, Schwartz selezionò l’imaging label-free di Nanolive, in quanto rappresenta una strategia completa e unbiased per ottenere risultati robusti velocemente (Nanolive). Grazie all’olotomografia di Nanolive è possibile seguire il fenotipo cellulare nel tempo acquisendo informazioni sia a livello subcellulare che di popolazione. Fu sufficiente un semplice esperimento di confronto tra cellule infettate da SARS-CoV-2 e cellule controllo per osservare cambiamenti fenotipici sorprendenti. Sebbene la cell-cell fusion non sia una strategia di diffusione comune tra i virus della famiglia dei Coronaviridae, le cellule infettate da SARS-CoV-2 formarono un enorme sincizio nell’arco di 10 ore portando alla luce un’importante informazione riguardo la modalità di trasmissione del virus (Figura 1).
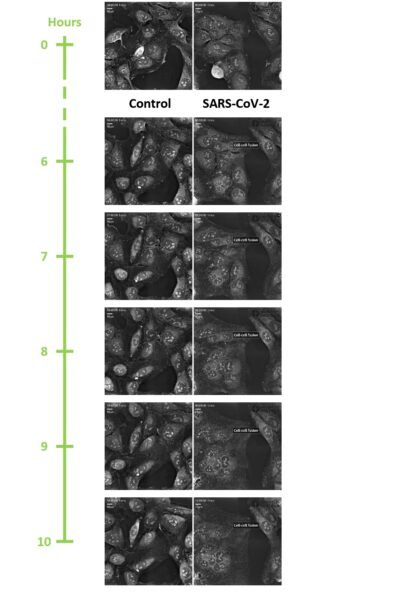
Figura 1: Frames di un esperimento in live-imaging prodotto con Nanolive (1 immagine ogni 10 minuti per 20 ore). Mentre le cellule nel campione di controllo proliferano, le cellule infettate con SARS-CoV-2 iniziano a fondere tra di loro formando un’unica grande cellula multinucleata. Il primo evento di cell-cell fusion avviene attorno alla sesta ora di registrazione innescando una reazione a catena che porta alla generazione del sincizio in poche ore.
Attualmente, Schwartz e colleghi stanno continuando lo studio degli effetti del SARS-CoV-2 tentando inoltre di comprendere e scoprire strategie immunologiche per contrastare la SARS-CoV-2-driven cell-cell fusion.



