L’uso di liposomi e altre vescicole lipidiche in campo farmaceutico e nutraceutico ha introdotto modalità innovative di somministrazione di farmaci e bioattivi.
I liposomi sono vescicole sferiche costituite da almeno un doppio strato lipidico, in cui è possibile incapsulare un’ampia gamma di molecole, proteggendole dalla degradazione enzimatica o termica e aumentandone al contempo la biodisponibilità. La peculiarità dei liposomi risiede nella loro struttura, che consente il trasporto di composti sia idrofili che idrofobi, facilitando il rilascio mirato e controllato dei farmaci con ridotti effetti collaterali.
Nei 40 anni successivi alla scoperta da parte del Dott. Bangham (negli anni ’60), i liposomi sono stati prodotti utilizzando metodi di sintesi convenzionali, caratterizzati da significativi svantaggi legati principalmente all’uso di solventi organici.
Una soluzione efficace per superare gli svantaggi dei metodi convenzionali è stata proposta con l’uso di fluidi supercritici. Questa tecnologia non solo consente un controllo più ecologico e migliorato sulla distribuzione granulometrica dei liposomi, ma garantisce anche la ripetibilità e la versatilità del processo. Un ulteriore progresso nella tecnologia di produzione dei liposomi è rappresentato dalle tecniche di essiccazione a spruzzo e di liofilizzazione. La liofilizzazione rimuove l’acqua dai liposomi congelati tramite sublimazione, trasformandoli in una polvere fine e omogenea. Questo non solo facilita la conservazione e la trasformazione delle formulazioni a base di liposomi, ma garantisce anche una maggiore stabilità del prodotto finale, consentendo una conservazione a lungo termine del farmaco intrappolato, senza significative perdite di efficacia.
Pertanto, la combinazione della produzione di vescicole lipidiche con fluidi supercritici e liofilizzazione rappresenta un progresso significativo nella creazione di integratori alimentari più sicuri, più efficaci e sostenibili, ma anche per la progettazione di sistemi di somministrazione di farmaci.
Il solfato ferroso è un importante integratore alimentare: è una fonte di ferro, un minerale essenziale, componente chiave nella formazione dei globuli rossi e dell’emoglobina. Questa molecola particolarmente instabile può essere intrappolata nei liposomi per creare un sistema di somministrazione stabile ed efficiente, pronto per il mercato. L’integratore in forma liposomiale è caratterizzato da una maggiore biodisponibilità e da un miglior assorbimento da parte dell’organismo.
La buona qualità del processo di produzione viene accertata mediante il controllo di alcuni parametri specifici, come la distribuzione granulometrica, l’efficienza di incapsulamento, la stabilità, la sterilità e la sicurezza nel tempo.

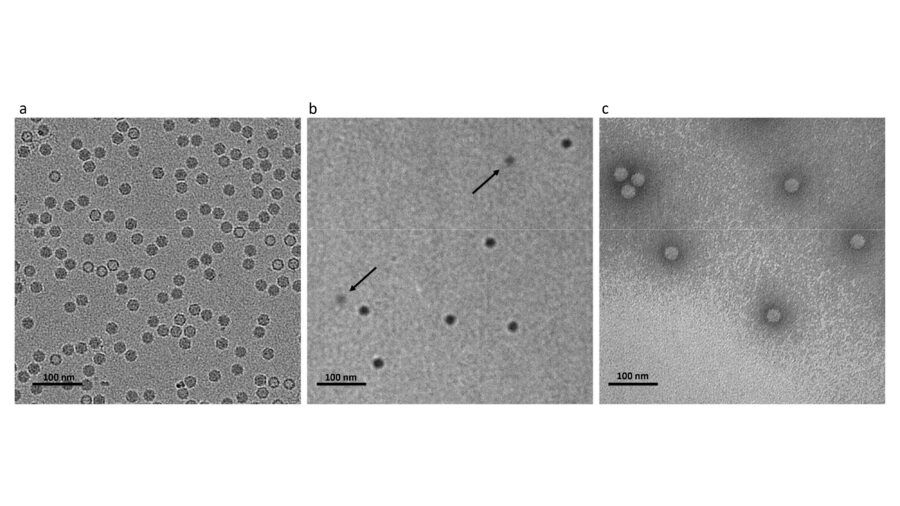
Fig.1 – Immagini acquisite al SEM a diversi ingrandimenti, fino a 50.000x, su campione di Ferro Solfato liposomiale.
In particolare, tramite il SEM (microscopio elettronico a scansione), il laboratorio dedicato al controllo qualità può verificare la granulometria della polvere su scala nanometrica, e indagare la presenza di aggregati dopo il processo di essicazione. Le polveri liposomiali possono essere ulteriormente analizzate con detector EDS (spettroscopia a dispersione di energia), che permette di rilevare le specie ferrose incapsulate e studiarne la distribuzione nella matrice liposomiale.

Fig.2 – Spettro EDS acquisito su porzione di campione di Ferro Solfato Liposomiale per l’analisi qualitativa e semiquantitativa delle specie ferrose.
Per l’analisi al SEM-EDS questa tipologia di campione necessita di essere metallizzato per diventare elettricamente conduttivo, ad esempio con un sottile strato d’oro utilizzando uno sputter coater.
Nota: Le immagini contenute in questo articolo sono state acquisite da Media System Lab s.r.l. con SEM Coxem EM-40 su un campione gentilmente fornito da IODO srl.
Bibliografia: Daniele Sofia, Massimo Moffa, Paolo Trucillo, “Supercritical PArticle formation (SPAF) process for the versatile production of ready-to-market drug delivery systems”, Chemical Engineering Science, Volume 302, Part B, 2025, 120918, ISSN 0009-2509, https://doi.org/10.1016/j.ces.2024.120918.